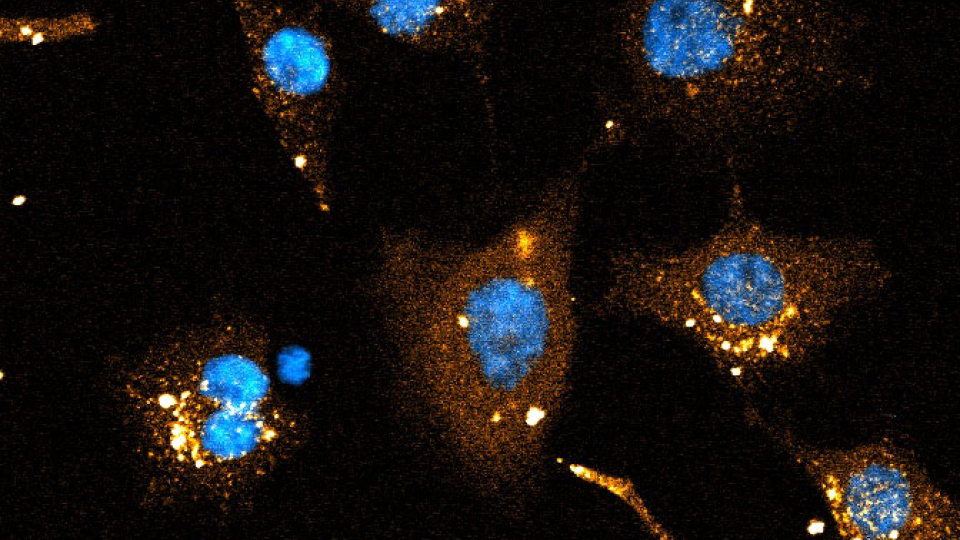
Forskare vid Lunds universitet har utvecklat en metod för att mäta hur många RNA-molekyler som levereras in i en cell. Kunskapen är värdefull när man undersöker dosmängd vid RNA-läkemedels– och vaccinforskning, inte minst inom områden som cancer, virus- och bakterieinfektioner.
Under pandemin blev det tydligt vilka möjligheter de genetiska budbärarmolekylerna (mRNA) öppnar upp för, då man för första gången utvecklade och använde ett mRNA-vaccin. I det fallet handlade det om vaccin mot covid, men det har sedan 1990-talet pågått intensiva studier för att använda mRNA, så kallat budbärar-RNA, även för andra tillämpningar, bland annat som cancervacciner.
En annan användning av RNA som läkemedel bygger på så kallade siRNA. Det är små dubbelsträngade RNA-molekyler som kan användas för att stänga av eller nedreglera i princip vilken gen som helst, ett fenomen som kallas RNA-interferens. Möjligheten att med siRNA nedreglera eller stänga av sjukdomsframkallande gener gör dem mycket attraktiva som potentiella läkemedel och ett flertal läkemedel som bygger på siRNA har blivit godkända de senaste åren.
Levern lättast att nå

– Förhoppningarna är också stora kring hur terapier baserade på mRNA ska hjälpa våra kroppar att tillverka sina egna läkemedel för att behandla sjukdom. Detta görs genom att mRNA skickar instruktioner till kroppens celler om vilka proteiner som behöver produceras. Gemensamt för alla RNA-läkemedel är dock att man än så länge endast kan leverera RNA molekylerna till några få organ, framför allt levern, vilket starkt begränsar vilka sjukdomar som kan angripas, säger Anders Wittrup, forskare vid Lunds universitet och cancerläkare vid Skånes universitetssjukhus, som lett studien.
Studien som har publicerats i Nature Communications och som letts från Lunds universitet, visar hur forskarnas metod kan användas för att räkna antalet RNA-molekyler som levereras in i en cell vid ett givet tillfälle, vilket kommer att vara vägledande i försöken att nå fler vävnader.
– Detta har inte gått att mäta på cellnivå tidigare. Det här ger verktyg som hjälper oss att beräkna så kallad dos-respons, alltså hur många molekyler behöver vi få in i en cell för en önskad effekt. Vi kan för första gången mäta ned till hundratalet molekyler i en enstaka cell. Detta är värdefullt i arbetet med att identifiera lovande nya metoder för att leverera RNA till vävnader och celler vi inte tidigare kunnat nå, som tumörer, säger Anders Wittrup.
Stänga av cancergener
Anders Wittrup och hans forskargrupp utvecklar metoder för att studera själva leveransen av RNA. De studerar även metoder för att bättre kunna leverera RNA till tumörer, för att på så vis kunna stänga av drivande cancergener och på så vis bromsa cancertillväxten.
Mätning med liten felmarginal

Det finns flera utmaningar i utvecklingen av dessa läkemedel och vacciner. En handlar om att hur RNA ska ta sig till just de organ och vävnader där de gör nytta. En metod som fått stor användning i bland annat covid-vaccinen är att paketera RNA molekylerna i mycket små fettpartiklar vilket underlättar leveransen av dessa molekyler till det inre av cellerna, men processen är för närvarande mycket ineffektiv och mindre än 1 procent av RNA-molekylerna tros hamna på rätt plats. För att forskarvärlden ska lyckas hitta lösningar behövs nya metoder som hjälper forskarna att se hur många av RNA-molekylerna som verkligen når in i cellerna de studerar. Hur fungerar då metoden som lundaforskarna utvecklat? Enkelt uttryck mäter forskarna signaler från RNA-molekylerna i cellen och med hjälp av matematiska och statistiska metoder kan de räkna ut hur många de är.
– Felmarginalen är väldigt liten. I de fall där vi har hög signal från cellerna vid mätning har vi cirka 10 procents felmarginal, medan vi vid svag signal hade 30 procents felmarginal. Det är väldigt stabila resultat, säger Jonas Wallin, forskare i statistik vid Lunds universitet och en av medförfattarna till studien.
Länk till vetenskaplig publikation ”Single-cell quantification and dose-response of cytosolic siRNA delivery”
Text: TOVE SMEDS
Artikeln har tidigare publicerats av Lunds universitet