Ett felaktigt protein som klumpar ihop sig i hjärnans blodkärl är orsaken till hjärnblödning och för tidig död hos unga islänningar. Forskare i Lund har hittat mekanismen bakom varför proteinerna klumpar ihop sig, vilket öppnar möjligheter för utveckling av nya läkemedel. Resultaten tyder dessutom på att en snarlik mekanism kan ligga bakom Alzheimer och Creutzfeldt-Jakobs sjukdom.
En enda felaktig byggsten i ett protein, en så kallad punktmutation, är orsaken till att unga personer, kanske redan i tonåren, drabbas av hjärnblödning som leder till en för tidig död, i de flesta fall före 30-års ålder.
– Sjukdomen har en hundraprocentig penetrans, det vill säga alla som har den felaktiga byggstenen drabbas av sjukdomen, frågan är bara när, säger Anders Grubb, professor i Klinisk kemi vid Labmedicin i Region Skåne.
Avlagringar spräcker blodkärl
Sjukdomen är ärftlig och förekommer framför allt på Island. Den orsakas av att det muterade proteinet L68Q, en variant av cystatin C, bildar långa repliknande proteinkedjor, fibriller, som klumpar ihop sig och bildar avlagringar i bland annat hjärnans blodkärl. Detta leder så småningom till att blodkärlet spricker och det uppstår en hjärnblödning.
Det var på 1980-talet som isländska forskare upptäckte att avlagringarna i blodkärlen bestod av långa trådar av den muterade varianten av cystatin C. För att försöka förstå sjukdomen kontaktades Anders Grubb, som redan då forskade på cystatin C, men det skulle dröja fram till slutet av 90-talet innan man, i samarbete med ett polskt forskarlag, lyckades bestämma den tredimensionella strukturen av proteinet. Då kom nästa överraskning. Proteinmolekylerna bildade par med varandra, så kallade dimerer.
Par i cystatin
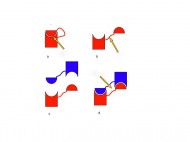
– I naturligt tillstånd kan proteinet liknas vid en knuten hand där de övriga fingrarna sluter sig om tummen. I dimeren hade handen öppnat sig, tummen hade svängt ut, varefter händerna återigen hade slutit sig men då om varandras tummar. Att delar av proteiner på det här viset byter plats med varandra kallas för ”domain swapping”, säger Maria Wahlbom, idag disputerad forskare, men som i början på 2000-talet var nyantagen doktorand hos Anders Grubb.
Dessa dimerer hade man även sett hos de isländska patienterna och Maria Wahlbom ställde sig frågan om fler proteiner kunde haka i varandra enligt samma mekanism och på så sätt bilda de långa fibriller, som man hade hittat i blodkärlsavlagringarna hos patienterna.
Inga kedjor utan ”domain swapping”
Maria Wahlbom påbörjade en mödosam process med att skapa varianter av cystatin C, både det naturliga och det muterade L68Q, där hon på kemisk väg stabiliserade proteinet genom att klistra fast tummen vid handen så att den inte kunde svänga ut. Hon ville se om detta kunde förhindra att det bildades dimerer och fibriller.
– Och det gjorde det! Mina resultat visade att om man klistrar fast tummen, då händer ingenting. Utan ”domain swapping”, ingen dimerisering och ingen fibrillisering.
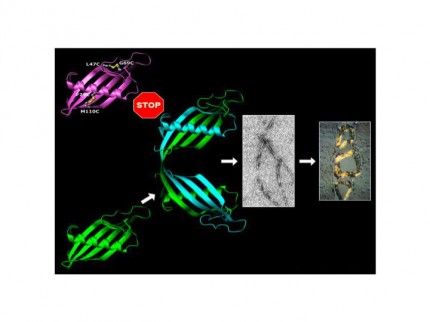
Maria Wahlbom har visat att ”domain swapping” är oerhört centralt för att fibrilliseringen ska kunna ske. Den här kunskapen är ytterst intressant om man vill ta fram läkemedel mot sjukdomen.
Läkemedel som stabiliserar
Det muterade L68Q är mycket instabilt och förekommer i princip inte alls i oparad form. Tyvärr går det inte att använda samma kemiska stabiliseringssystem, som Maria använde i provrör, på levande patienter. Därför har nu två nya doktorander hos Anders Grubb börjat undersöka andra möjligheter att stabilisera proteinet, vilka skulle kunna fungera även in vivo, d.v.s. i levande organismer.
Det ena spåret är att testa ett antal olika antikroppar för att se om de kan binda till proteinet på ett sådant sätt att det förhindrar ”domain swapping”. I det andra fallet går man igenom 1200 kända läkemedel för att se om de har någon stabiliserande effekt. Hittills har man hittat fyra eller fem kandidater som stabiliserar något men kanske inte tillräckligt.
– Fördelen med att testa kända läkemedel är att de redan är godkända för användning på människor och behöver då bara godkännas för användning vid just den specifika sjukdomen, säger Anders Grubb.
Även Alzheimers sjukdom
Förutom att man kanske är ett nytt läkemedel mot cystatin C-relaterad hjärnblödning på spåret, kan ”domain swapping” vara en intressant förklaringsmodell även vid andra sjukdomar som Alzheimers och Creutzfeldt-Jakobs sjukdom (den mänskliga varianten av galna ko-sjukan).
Båda dessa sjukdomar karaktäriseras av att proteiner, andra än cystatin C, förändras och bildar fibriller. I elektronmikroskop har man vid dessa sjukdomar dessutom kunnat se speciella ringstrukturer som visat sig vara kortare, ringslutna proteinkedjor av de förändrade proteinerna.
Gemensamma strukturer
– Jag har visat att även cystatin C bildar mycket snarlika ringstrukturer och att bildningen av dessa stoppas om man förhindrar ”domain swapping”. Om man renar upp ringarna kan de bilda fibriller, vilket tyder på att de är byggstenar i fibrillerna, säger Maria Wahlbom.
Kopplingen till ringstrukturerna som man har påvisat vid alla tre sjukdomarna och att ”domain swapping” har konstaterats även vid Creutzfeldt-Jakobs sjukdom gör att det finns skäl till att misstänka att samma eller en snarlik mekanism ligger bakom alla tre sjukdomarna.
Läkemedel som förhindrar ”domain swapping” skulle i så fall kunna bli intressanta även mot Creutzfeldt-Jakobs sjukdom eller till och med Alzheimer. Men fler undersökningar måste göras för att bevisa detta.
Text och foto: EVA BARTONEK ROXÅ